|
Estudio histopatológico del recubrimiento pulpar directo e
indirecto con adhesivos dentinarios en dientes humanos
Dr. Roberto Espinosa Fernández
Profesor del Postgrado de Prostodoncia, Facultad de Odontología,
Centro Universitario de Ciencias de la Salud, Universidad de
Guadalajara. México.
e-mail:
robertoesp@avantel.net
Dr. Álvaro Cruz González
Profesor de Endodoncia, Facultad de Odontología, Centro
Universitario de Ciencias de la Salud, Universidad de
Guadalajara. México.
Dr. Diego Espinosa Sánchez
Egresado de la escuela de Odontología,
Centro Universitario de Ciencias de la Salud, Universidad de
Guadalajara. México
Dr. Eduardo Flores Herrera
Egresado del Postgrado de Prostodoncia, Centro Universitario de
Ciencias de la Salud, Universidad de Guadalajara. México.
Dr. Israel Ceja Andrade
Maestría en Ciencias de la Salud Ambiental. Investigador del
Centro de Ciencias Exactas en Ingeniería, Universidad de
Guadalajara, México.
Resumen
Introducción-
Las técnicas adhesivas actuales han incluido el grabado ácido y adhesivo como
terapia de recubrimiento directo e indirecto. El objetivo de este estudio in
vivo fue evaluar los posibles cambios histológicos de la pulpa dental humana
como resultado del recubrimiento indirecto y directo con adhesivos en dientes
humanos.
Materiales y Métodos- Fueron utilizadas 60 piezas dentales que requerían
extracción por indicaciones periodontales. Se elaboraron cavidades clase V en
todas las muestras. Las muestras se dividieron en 4 grupos: Grupo # 1,
Recubrimiento indirecto sistemas adhesivos de grabado total. Grupo # 2,
recubrimiento indirecto con hidróxido de calcio
cubierto por un delineador de Ionómero de vidrio (DIV). Grupo # 3,
recubrimiento directo con sistemas adhesivos de grabado total. Y grupo # 4,
recubrimiento directo con
Ca (OH)2 y DIV. Al término de
6 meses las muestras fueron extraídas y preparadas para ser observadas al
microscopio electrónico de barrido y con cortes histológicos para el análisis
histopatológico.
Resultados: Las
muestras de los grupos # 1 y # 3 mostraron situaciones similares: inflamación
crónica, grandes áreas de necrosis, glóbulos de adhesivo y presencia de
macrófagos. Las muestras de los grupos # 2 y # 4 con resultados similares;
reorganización celular, formación de puente dentinario y dentina
reparadora.
Conclusiones y Recomendaciones: De acuerdo con los resultados
obtenidos podemos concluir que en los recubrimientos directos e indirectos con
adhesivos, el adhesivo penetra a la pulpa, causando una reacción inflamatoria
crónica y toxicidad celular. Mientras que aplicando una base se reorganizan las
células pulpares formando puente dentinario con dentina reparadora. En zonas de
dentina profunda es recomendable aplicar (Ca (OH)2)
y DIV para evitar la toxicidad de los adhesivos a la pulpa evitando
patologías pulpares.
Summary
Introduction-
The modern adhesive techniques have included acid etching and adhesives as
direct and indirect pulp capping therapy. The objective of this in vivo study
was to evaluate the possible histological changes of the dental pulp as a result
of the direct and indirect pulp capping with adhesives in human teeth.
Materials and Methods- 60 teeth that required extraction due to periodontal
problems were used; class V cavities were prepared in
all of them.
The teeth were divided into 4 groups: Group # 1, indirect pulp capping with
total etch adhesive systems. Group # 2, indirect pulp capping with calcium
hydroxide and a glass ionomer liner. Group # 3, direct pulp capping with total
etch adhesive systems. Group # 4, direct pulp capping with calcium hydroxide and
a glass ionomer liner. After 6 months all teeth were extracted and prepared for
scanning electron microscope and for histopathologic analysis.
Results: Pulps
of groups # 1 and # 3 showed similar results: severe chronic, large areas of
necrosis, and presence of macrophages wrapped around the
adhesive particles. The pulps of groups # 2 y
# 4 showed similar results: no inflammation, tisular reorganization, formation
of a dentinal bridge and reparative dentin.
Conclusions and Recommendations:
According to the obtained results, we can conclude that in the direct and
indirect pulp capping with adhesives, they penetrate the pulp causing chronic
inflammatory reaction and cellular toxicity. Meanwhile, when a liner is used,
pulpal tissue is reorganized and dentinal bridge and reparative dentin are
formed. In deep zones of the dentin, it is recommendable to apply calcium
hydroxide and a glass ionomer liner in order to avoid toxicity of the adhesives
to the pulp and therefore avoid pulp pathology.
Palabras Clave:
Adhesivos, Citotoxicidad, Hidróxido de Calcio, Recubrimiento pulpar.
Keywords:
Adhesives, Citotoxicity, Calcium Hydroxide, Pulp Capping.
Introducción
Los
sistemas de adhesión actuales nos han abierto una infinidad de posibilidades
para la aplicación de nuevos tratamientos con éxito, gracias a la hibridación,
que forma una excelente unión mecánica entre la resina y la dentina; lo que nos
abre nuevas expectativas en la odontología restauradora.
Con frecuencia se
olvidan los cuidados que se deben tener para no causar irritación
pulpar como resultado de los procedimientos clínicos. Las reacciones pulpares
causadas por los materiales restauradores, dependen de la estructura y la
cantidad de dentina remanente entre la preparación y la pulpa,
usualmente llamada
Grosor de dentina remanente. El remanente dentinario de más de 2 mm es
considerado adecuado para efectuar procedimientos restauradores, aún si se
emplean técnicas adhesivas (Christensen, 1994; Majör, 2002).
Las
técnicas adhesivas actuales han incluido grabado ácido y adhesivos como terapia
de recubrimiento directo e indirecto. Algunos autores aseguran que el grabado
dentinario profundo no causa daño pulpar ni efectos tóxicos causados por los
materiales utilizados en las técnicas adhesivas (Bränström,
1978; Fusayama, 1987), sin embargo otros autores
aseguran que el grabado ácido y posterior restauración causa irritación,
patología pulpar y fenómenos histopatológicos de reabsorción interna, cuando
éste es aplicado en cavidades profundas con grosores de dentina remanente de 0.5
a 1 mm (Hebling, 1999; Stanley, HR. 1975).
Estudios clínicos de investigación han demostrado que debido al uso de los
sistemas de grabado dentinario y adhesivos, se han incrementado
significativamente los efectos pulpares adversos (Gerurtsen, W. 2000;
Cox CF. et al.1998; Camps, J.
et al. 2000), poniendo así en duda la biocompatibilidad de los componentes
de los adhesivos.
La
difusión intertubular es la capacidad de un material a propagarse por el túbulo
dentinario; ésta es proporcional a la longitud y diámetro de los túbulos y
al peso molecular de las sustancias (Pashley, DH. et al. 1984; Bränström, M.
1966). Los adhesivos modernos contienen una gran cantidad de HEMA (2-hidroxietil
metacrilato) con un peso molecular de 130 (Craig R. 1998). Este componente
permite una excelente interdigitación entre el adhesivo y la dentina modificada.
Sin embargo, en zonas cercanas a la cámara pulpar el HEMA tiene la capacidad de
difundirse a través de los túbulos hasta llegar a cámara pulpar y causar
patología pulpar (Camps, 2000; Pashley, et al 2000).
El
objetivo de este estudio in vivo fue evaluar los posibles cambios
histológicos de la pulpa dental como resultado del recubrimiento indirecto y
directo con adhesivos en dientes humanos.
Materiales y Métodos
Fueron utilizadas 60 piezas dentales, las que requerían extracción por
indicaciones periodontales. Las muestras correspondían a 10 pacientes, cuyas
edades en promedio fue de 54 años, siendo el menor de 47 y el mayor de 61. Este
estudio se efectuó de acuerdo con los lineamientos establecidos en el código de
bioética para Odontólogos de la Secretaría de Salud, la Norma Oficial Mexicana y
la Normatividad vigente de Bioética de la Universidad de Guadalajara. Los
pacientes que aceptaron participar en este estudio autorizaron por escrito los
tratamientos y procedimientos para el mismo.
Fueron
seleccionados dientes sanos, que aunque algunos de ellos presentaban
restauraciones y desgastes, no presentaban lesiones cariosas ni fracturas. En el
diagnóstico inicial los pacientes no reportaron síntoma alguno. Ningún diente
propuesto para el estudio presentaba patología periapical, corroborado
radiográficamente, y presentaron respuesta positiva a las pruebas de vitalidad
pulpar.
Se
elaboraron cavidades clase V en todas las muestras. A los pacientes se les
efectuaron obturaciones con las dos técnicas. De las 60 muestras se prepararon
40 muy cerca de la pulpa sin comunicación pulpar y 20 con comunicación
pulpar franca. Las muestras se dividieron en 4 grupos: El grupo # 1 de 20
dientes efectuándoles el recubrimiento indirecto con un sistema adhesivo de
grabado total y resina, el grupo # 2 de 20 dientes, a los que se les efectuó
recubrimiento indirecto con hidróxido de calcio (Ca(OH)2) cubierto
por una capa de delineador de ionómero de vidrio (DIV), procediendo a la
aplicación el sistema adhesivo de grabado total y resina. El grupo # 3 de 10
dientes, a los que se les efectuaron preparaciones con comunicación pulpar y
recubrimiento directo con el sistema adhesivo de grabado total y resina y. El
grupo # 4 con preparaciones con comunicación pulpar efectuando el recubrimiento
pulpar directo con Ca(OH)2, DIV previo al mismo sistema adhesivo
(Tabla Nº 1).
|
Tabla Nº 1.- Grupos y
Distribución de muestras, material de recubrimiento y
formas de evaluación |
|
Grupos |
Recubrimiento |
Material de
recubrimiento |
Numero de
muestras |
Evaluación
Histológica |
Evaluación
Mic. Electrónica |
|
1 |
Indirecto |
Sistema adhesivo |
20 |
10 |
10 |
|
2 |
Indirecto |
Ca(OH)2 y DIV |
20 |
10 |
10 |
|
3 |
Directo |
Sistema adhesivo |
10 |
10 |
|
|
4 |
Directo |
Ca(OH)2 y DIV |
10 |
10 |
|
|
Procedimientos clínicos:
La preparación de
la cavidad de los dientes de los primeros dos grupos fueron efectuadas de
acuerdo a los siguientes pasos: Posterior a la aplicación de anestésico local y
al aislamiento total del campo operatorio con dique de hule, se hicieron
cavidades cercanas a la cámara pulpar, con una fresa de diamante de grano grueso
# 6856 (Brasseler, USA) usando alta velocidad e irrigación con agua y aire. El
recubrimiento indirecto de cada muestra del grupo # 1 se efectuó con un sistema
adhesivo, utilizado el sistema Singlebond y la resina Filtek Z250 (3M),
siguiendo las indicaciones del fabricante:
Se secó cada cavidad con aire, inmediatamente después se grabó el esmalte y la
dentina con ácido fosfórico al 37 % (Scotchbond, 3M) durante 15 segundos.
Después del lavado profuso se retiró el exceso de humedad dentro de la cavidad
con una torunda de algodón estéril, asegurándonos de no deshidratar la dentina.
Se aplicaron 2 capas de adhesivo dentinario (Singlebond, 3M) y se evaporó el
solvente durante 15 segundos con una ráfaga suave de aire, polimerizando
el adhesivo durante 20 segundos, procediendo a una segunda aplicación del
adhesivo como se describió anteriormente, y se realizó la restauración aplicando
la resina (Filtek Z250, 3M) utilizando la técnica de capas incrementales
en forma oblicua, polimerizando cada una de ellas por 20 segundos. En las 20
muestras del grupo # 2 se aplicó en la zona más cercana a la pulpa un
punto de Ca(OH)2 puro mezclado con agua estéril cubriéndolo con un
DIV (Vitremer, 3M), la restauración se efectuó siguiendo los mismos
procedimientos restaurativos antes descritos.
A las
20 muestras de los
grupos # 3 y # 4, se le efectuaron preparaciones profundas
siguiendo el mismo procedimiento de las grupos anteriores, ya efectuados estos
pasos se utilizo una fresa de carburo Nº 330 con la que se efectuó la
comunicación pulpar, procediendo al lavado profuso de la cavidad con suero
fisiológico hasta que cedió la hemorragia. El recubrimiento directo efectuado en
las 10 muestras del grupo # 3 se llevó a cabo con el mismo adhesivo que el grupo
# 1 y siguiendo los mismos pasos. Las 10 muestras del grupo # 4, el
recubrimiento directo se efectuó con Ca(OH)2 siguiendo los mismos
pasos del grupo # 2.
Los pacientes
incluidos en el estudio recibieron cuando menos dos diferentes tratamientos,
aunque no fue posible en todos ellos, se intentó que a cada uno se le efectuaran
los cuatro tratamientos antes descritos.
|
Tabla Nº 2.-
Procedimientos clínicos de cada grupo |
|
Grupos |
Profundidad de
la preparación |
Tipo de
Recubrimiento |
Lavado con
suero fisiológico |
Ca(OH)2
y
DIV |
Grabado
fosfórico al 35% |
Dos capas de
adhesivo dentinario |
Resina
compuesta |
|
1 |
Cerca de
pulpa |
Indirecto |
● |
|
● |
● |
● |
|
2 |
Cerca de
pulpa |
Indirecto |
● |
● |
● |
● |
● |
|
3 |
Comunicación
pulpar |
Directo |
● |
|
● |
● |
● |
|
4 |
Comunicación
pulpar |
Directo |
● |
● |
● |
● |
● |
|
Los
pacientes fueron citados a evaluación bimestral, ésta se efectuó por medio de la
inspección clínica previo interrogatorio de los posibles síntomas. Las pruebas
de vitalidad pulpar se efectuaron en cada pieza dental incluida en el estudio,
buscando cualquier diferencia tanto en hipersensibilidad o de posible
necrosis. Finalmente se tomaron radiografías periapicales. Este procedimiento
evaluación se efectuó desde la evaluación de selección previa al estudio como
cada dos meses del periodo de seis meses que duró este estudio. Estos
resultados fueron plasmados en la historia clínica general del estudio (Tabla Nº
3).
|
Tabla Nº 3.- Evaluación bimestral de
las muestras |
|
|
Síntomas patológicos/vitalidad pulpar |
Evaluación radiográfica |
|
grupos |
60 días |
90 días |
180 días |
60 días |
90 días |
180 días |
|
1 |
sdp /100% |
sdp /100% |
sdp /100% |
sdp |
sdp |
sdp |
|
2 |
sdp /100% |
sdp /100% |
sdp /100% |
sdp |
sdp |
sdp |
|
3 |
sdp /100% |
sdp /100% |
sdp /100% |
sdp |
sdp |
sdp |
|
4 |
sdp /100% |
sdp /100% |
sdp /100% |
sdp |
sdp |
sdp |
|
sdp = Sin datos patológicos |
|
Conforme los especímenes llegaron a los 180 días, se efectuaron las
exodoncias hasta completar todos los grupos.
Preparación de
las muestras para microscopía electrónica:
Fueron utilizadas
10 muestras de cada uno de los grupos # 1 y # 2, para ser analizadas en el
microscopio electrónico de barrido. Posterior a la extracción estas 20 muestras
fueron mantenidas inmersas en solución salina. 24 horas después se cortó la raíz
de los dientes con un disco de diamante, manteniendo exclusivamente las coronas
anatómicas. Con el fin de eliminar todo material orgánico alojado dentro de la
cavidad pulpar, las muestras fueron sumergidas en hipoclorito de sodio al 6%
durante 20 minutos. A continuación se lavaron con agua corriente y se secaron.
Se procedió a elaborar un corte con disco de diamante exclusivamente en esmalte
en sentido vestíbulo lingual. Posteriormente se seccionaron los dientes por
golpe con un cincel # 3G-0090 (American Dental) y martillo, con el fin de
preservar las estructuras internas sin desgastes ni presencia de elementos
extraños.
Las muestras fueron
preparadas para ser observadas en el microscopio electrónico de barrido (SEM)
(JEOL JSM-5400 LB). Se montaron sobre una platina y se recubrieron con oro de 24
quilates por medio de Sputtering (JEOL), con el objetivo de poder ser analizadas
al alto vacío cada una de ellas en el microscopio electrónico.
Preparación de las muestras para
cortes histológicos:
Al término de los
180 días se efectuaron las extracciones utilizando principalmente elevadores,
cuando fue necesario, el uso de fórceps se aplicó sobre la raíz lo más
apical posible para no causar daños en la zona de la restauración.
Inmediatamente después de la extracción se corto la raíz por la mitad con una
fresa de carburo Nº 701-L (Jet, Beavers Dental) con enfriamiento de agua y
aire, de esta forma se promueve la fácil y rápida penetración del fijador. Las
muestras se sumergieron en formaldehído al 10% (pH 7.4) durante 72 horas. Con el
fin de descalcificarlos se sumergieron los grupos en ácido etilen diamino
tetra-acético trisódico al 17% (EDTA) en continua agitación durante 5 meses,
renovando el ácido semanalmente. Al término de este tiempo se procedió a incluir
las muestras en parafina para la elaboración de los cortes en un microtomo y su
montaje en portaobjetos. Se procesaron 20 cortes seriados de cada pieza de la
zona de la cavidad. Se utilizó tinción de hematoxilina y eosina procediendo al
análisis microscópico de cada una de ellas a magnificaciones de 100X, 400X y
1000X.
Resultados
Los
resultados de la evaluación bimestral se muestran en la tabla Nº 3, donde se
aprecia que tanto en las pruebas de vitalidad pulpar, como en los estudios
radiográficos en todo el tiempo que duró el estudio no se presentaron síntomas
ni signos de patología pulpar o evidencias radiográficas de lesiones
periapicales .
Microscopía
electrónica:
La
evaluación al microscopio electrónico solamente se efectuó en las 20 muestras;
10 del grupo # 1 y 10 del grupo # 2, Las muestras de los grupos # 3 y # 4, no se
analizaron por medio de este sistema puesto que al efectuar la comunicación
pulpar se elimina la dentina que es el objeto de esta evaluación.
Por
medio del análisis al microscopio electrónico se observó y midió el grosor de
dentina remanente, resultando que el espesor de dentina remanente de todas las
muestras de los dos grupos, fue menor a 1 mm. Los resultados de las 10
muestras del grupo # 1 (recubrimiento indirecto con resinas), se observó, que
dentro de los túbulos dentinarios en toda su longitud presentan adhesivo
dentinario, desde el piso de la cavidad hasta la cámara pulpar.
El
adhesivo penetró por los túbulos dentinarios fluyendo hasta la cámara pulpar
impregnando totalmente la predentina, de esta forma se formó una mezcla de
adhesivo y predentina. Se encontró además grandes residuos irregulares del mismo
adhesivo, formando prolongaciones dentro de la cámara pulpar (figura Nº
1).
|

Figura N- 1.-
Microfotografía al microscopio electrónico de barrido. Muestra del grupo # 1.
Dentina de la cámara pulpar vista desde el interior de la cámara pulpar. Observe
la dentina y predentina impregnada totalmente por el adhesivo dentinario y el
odontoblasto que ha quedado “petrificado” en esta masa de material extraño a la
pulpa. 3,500 X |
Los
resultados del análisis de las 10 muestras del grupo # 2 (recubrimiento
indirecto con Ca(OH)2 y DIV, muestran el espesor de dentina
remanente es similar al del grupo # 1. Se observó los túbulos dentinarios en
toda su longitud libres de adhesivo. Los túbulos en el extremo pulpar se
encuentran totalmente vacíos sin residuos de adhesivo y la dentina del techo de
la cámara pulpar se encuentra libre de elementos extraños (figura Nº 2).
|
 Figura
N 2.-
Microfotografía al microscopio electrónico de
barrido. Muestra del grupo # 2. Vista de la dentina desde el
interior de la cámara pulpar, los túbulos dentinarios y la
superficie dentinaria intertubular se encuentran libres de
materiales extraños. 3,500 X Figura
N 2.-
Microfotografía al microscopio electrónico de
barrido. Muestra del grupo # 2. Vista de la dentina desde el
interior de la cámara pulpar, los túbulos dentinarios y la
superficie dentinaria intertubular se encuentran libres de
materiales extraños. 3,500 X |
Resultados histopatológicos:
Los resultados
obtenidos de los cortes histológicos de las 10 muestras del grupo # 1, donde se
efectuó recubrimiento indirecto con grabado ácido y adhesivos fueron similares:
El remanente dentinario original se mantuvo del mismo espesor sin evidencia de
formación de dentina terciaria o de reparación. En el tejido pulpar cercano al
recubrimiento se observa lisis celular incluyendo la capa de odontoblastos,
llamó la atención la falta de la capa de predentina. Tanto la zona acelular,
como la zona rica en células se muestran con una total desorganización con pocos
fibroblastos dispersos, escasos vasos y de mayor diámetro y algunos macrófagos
(figura Nº 3). Se encontraron varios glóbulos de adhesivo dispersos en el
tejido pulpar, rodeados por macrófagos (figuras Nº 4 y 5). Las características
histopatológicas observadas en las muestras de este grupo mostraron un estado
inflamatorio crónico en proceso de necrosis, que se extiende inclusive a zonas
distantes del área del recubrimiento.
|
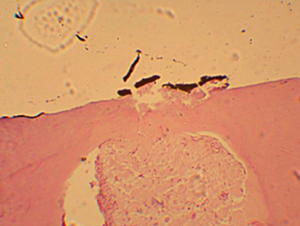
Figura N 3.-
Corte Histológico del grupo #1. El remanente dentinario original se mantuvo del
mismo espesor sin evidencias de
formación de dentina terciaria o de reparación. En el tejido pulpar cercano al
recubrimiento se observa la lisis de la capa de odontoblastos sin presencia de
la capa de predentina. Tanto la zona acelular, como la zona rica en células se
muestra con una total desorganización con pocos fibroblastos dispersos, escasos
vasos y de mayor diámetro y algunos macrófagos. 100 X |
|
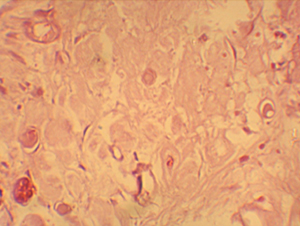 Figura
N 4.-
Corte Histológico del grupo # 1.
Se encontraron varios glóbulos de adhesivo,
inmersos en el tejido pulpar, rodeados por macrófagos. El proceso
inflamatorio crónico, que se extiende inclusive hasta un milímetro de
distancia del recubrimiento en el tejido conectivo. 400 X Figura
N 4.-
Corte Histológico del grupo # 1.
Se encontraron varios glóbulos de adhesivo,
inmersos en el tejido pulpar, rodeados por macrófagos. El proceso
inflamatorio crónico, que se extiende inclusive hasta un milímetro de
distancia del recubrimiento en el tejido conectivo. 400 X |
|
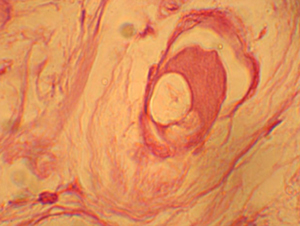 Figura
N 5.-
Acercamiento
de la figura anterior en donde se aprecia un glóbulo de adhesivo inmerso
en el tejido pulpar, rodeado por macrófagos. 1000 X Figura
N 5.-
Acercamiento
de la figura anterior en donde se aprecia un glóbulo de adhesivo inmerso
en el tejido pulpar, rodeado por macrófagos. 1000 X |
Las 10 muestras del
grupo # 2 en las que se efectuó recubrimiento indirecto con Ca(OH)2
y DIV a diferencia de las muestras anteriores, se observó formación de dentina
terciaria tanto en la zona del recubrimiento como en todo el perímetro de la
cámara pulpar, delimitándose claramente la línea calciotraumática donde
inició la formación de dentina reparadora con las siguientes características
histológicas: Túbulos dentinarios en menor diámetro y cantidad, áreas de dentina
atubular, amorfa e hipercalcificada (figuras Nº 6 y 7). La predentina se
distingue claramente acompañada por la capa de odontoblastos en posición y
cantidad normal, inmediatamente por debajo de éstos se aprecia el espacio
acelular donde se encuentra el plexo nervioso delimitado por la capa rica en
células, y por último el tejido conectivo en condiciones normales. La presencia
de vasos se muestra en cantidad y diámetro normal. Claramente se aprecia
organización celular y formación de predentina (figura Nº 8).
|
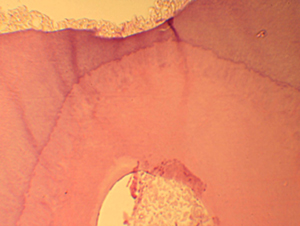
Figura N 6.-
Muestra del grupo # 2. Formación de
dentina terciaria tanto en la zona del recubrimiento como en todo el perímetro
de la cámara pulpar.
100 X |
|
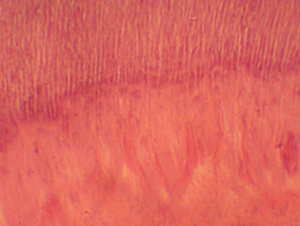
Figura N 7.-
Muestra del grupo # 2. Acercamiento de la
figura anterior. Se delimita claramente la línea calcio-traumática donde
inició la formación de dentina con las siguientes características histológicas:
Túbulos dentinarios en menor diámetro y cantidad, áreas dentina atubular, amorfa
e hipercalcificada. 400
X |
|
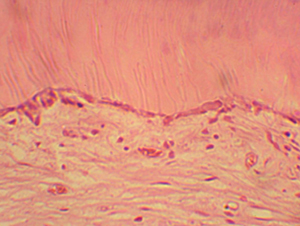 Figura
N 8.-
Muestra del grupo # 2.
Acercamiento de la zona
del recubrimiento. La predentina se distingue claramente acompañada por
la capa de odontoblastos en posición y cantidad normal, inmediatamente
por debajo de éstos de aprecia el espacio acelular donde se encuentra el
plexo nervioso delimitado por la capa rica en células, y por último el
tejido conectivo en condiciones normales. La presencia de vasos se
muestra en cantidad y diámetro normal. Claramente se aprecia
organización celular y formación de predentina. 1000 X Figura
N 8.-
Muestra del grupo # 2.
Acercamiento de la zona
del recubrimiento. La predentina se distingue claramente acompañada por
la capa de odontoblastos en posición y cantidad normal, inmediatamente
por debajo de éstos de aprecia el espacio acelular donde se encuentra el
plexo nervioso delimitado por la capa rica en células, y por último el
tejido conectivo en condiciones normales. La presencia de vasos se
muestra en cantidad y diámetro normal. Claramente se aprecia
organización celular y formación de predentina. 1000 X |
En
ninguna de las muestras del grupo # 3 se formó puente dentinario persistiendo el
contacto del tejido pulpar con el material de recubrimiento (figura Nº 9).
Se observan zonas de tejido necrótico coexistiendo con zonas de tejido mostrando
vasos hiperémicos,
siendo notable la desorganización del tejido y la ausencia de fibras colágenas y
fibroblastos, con una aparente coagulación de la matriz extracelular.
En tejido pulpar
cercano a la zona del recubrimiento se observa gran cantidad de exudado
inflamatorio, desorganización celular generalizada con disminución del número de
células, mostrando características de un proceso necrótico degenerativo. Las
muestras de este grupo se caracterizaron por presencia de muchas partículas
polimerizadas de adhesivo dentro de la cámara pulpar envueltas por macrófagos
(Figura Nº 10).
|
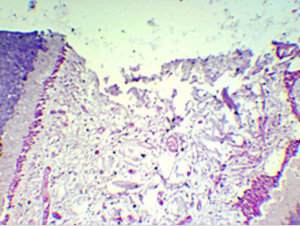
Figura N 9.-
Muestra del grupo # 4. Nula formación de puente
dentinario, persistiendo el contacto del tejido pulpar con el material de
recubrimiento, se encuentran varias zonas de tejido necrótico coexistiendo con
zonas de tejido vital mostrando vasos hiperémicos. Es notable la
desorganización del tejido y la ausencia de fibras colágenas y fibroblastos, con
una aparente coagulación de la matriz extracelular.
100 X |
|
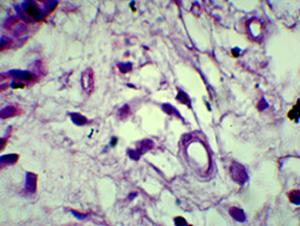
Figura N 10.-.
Acercamiento de la fotografía anterior. En tejido pulpar cercano a la zona
del recubrimiento se observa gran cantidad de exudado inflamatorio,
desorganización celular generalizada con disminución celular, presenta
características de un proceso necrótico degenerativo. Las muestras de este grupo
se caracterizaron por presencia de muchas partículas polimerizadas de adhesivo
dentro de la cámara pulpar envueltos por macrófagos. 400 X
|
Todas
las muestras del grupo # 4 mostraron formación de puente dentinario, con espesor
de dentina de reparación variable, predentina y capa de odontoblastos, además de
las características del proceso de reparación fisiológica con
reorganización
celular comparable con una
pulpa normal (figuras Nº 11 y 12).
|
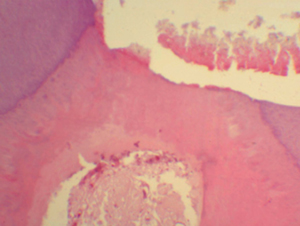 Figura
N 11.-
Muestra del grupo # 4. Se observa la formación del
puente dentinario, con buen espesor de dentina de reparación, predentina
y capa de odontoblastos, además de las características del proceso de
reparación fisiológica con reorganización celular comparable con
una dentina normal. 100 X Figura
N 11.-
Muestra del grupo # 4. Se observa la formación del
puente dentinario, con buen espesor de dentina de reparación, predentina
y capa de odontoblastos, además de las características del proceso de
reparación fisiológica con reorganización celular comparable con
una dentina normal. 100 X |
|
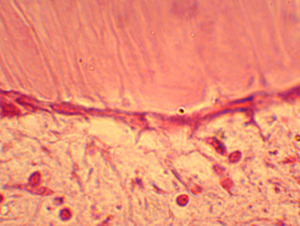
Figura N 12.-
Acercamiento de la fotografía anterior en la que se aprecia la predentina bien
formada conteniendo las prolongaciones citoplasmáticas, también la línea de
odontoblastos, la zona acelular, vasos sanguíneos y fibroblastos en cantidad y
distribución normal. 400 X |
|
Tabla Nº 4.- Resultados
histopatológicos |
|
grupos |
Formación de puente
dentinario |
Formación de dentina
reparadora |
Predentina |
Nódulos de necrosis |
Adhesivo en pulpa |
Exudado inflamatorio |
Macrófagos |
|
1 |
- |
no |
no |
si |
si |
si |
si |
|
2 |
- |
si |
si |
no |
no |
no |
no |
|
3 |
no |
no |
no |
si |
si |
si |
si |
|
4 |
si |
si |
si |
no |
no |
no |
no |
|
Discusión
La técnica del
grabado total en zonas profundas y la aplicación de adhesivos dentinarios como
recubrimiento pulpar directo e indirecto, ha sido adoptada por muchos
odontólogos para su aplicación a la clínica diaria, basados en el beneficio que
supuestamente brinda este tratamiento, buscando mayor retención y sellado de la
cavidad. Sin embargo varios autores, aunque reconocen que este sistema
favorece el sellado y retención, han demostrado que en los estratos profundos
las posibilidades de lesionar la pulpa son altas (Costa, Et al 1999). Numerosos
factores están relacionados con la aplicación del grabado en dentina profunda y
la aplicación de adhesivos. Es importante resaltar que no solamente el grabado
es el elemento agresor a la pulpa, sino también los componentes del adhesivo que
son tóxicos para las células pulpares (Mondelli, 1998).
10 de las 20
muestras del grupo # 1 a las que se efectuó recubrimiento indirecto fueron
analizadas al microscopio electrónico de barrido, demostraron la facilidad de
difusión que tienen los adhesivos en dentina profunda llegando a penetrar a la
cámara pulpar, los cortes histológicos ratificaron la presencia del adhesivo en
pulpa con su consecuente toxicidad del tejido pulpar; quedando demostrado que
los recubrimientos pulpares directos e indirectos con grabado ácido y
adhesivos no promueve los mecanismos de reparación biológica.
En condiciones
normales la predentina del interior de la cámara pulpar se compone de un gran
número de fibras colágenas entrelazadas conforman la matriz de la formación de
los siguientes estratos de dentina. El adhesivo penetró por los túbulos
dentinarios fluyendo hasta la cámara pulpar impregnando totalmente la
predentina, formando una mezcla de adhesivo y predentina conformando un bloque
similar a la lo que conocemos en la adhesión como hibridación, la penetración
del adhesivo fue de tal magnitud que envolvió gran cantidad de odontoblastos que
en el momento de la fotopolimerización quedaron incluidos dentro de esta masa
resinosa. Se encontró además grandes residuos irregulares del mismo adhesivo,
formando prolongaciones dentro de la cámara pulpar (figura Nº 1). Estos
residuos de adhesivo en la cámara pulpar envuelven la matriz dentinaria
causando la nula formación de dentina terciaria.
Son varios los
estudios in vivo que se han efectuado que concluyen que el método tradicional de
aplicación de una base de Ca(OH)2 en las zonas profundas, previo al
grabado y adhesivo ofrece a la pulpa el mejor tratamiento para su adecuada
reparación y mantener la pulpa exenta de patologías.( Costa, CA.et al 1999;
Rakich, DR. 1999; Shuster, GS. Et al 2000).
Los resultados de
este estudio de investigación confirman, los resultados obtenidos por otros
autores (Camps, J. et al 2000; Costa, CA. Hebling, J. 2002); Costa CA. 2003),
que concluyeron que la presencia de adhesivos en pulpa causa una
reacción inflamatoria crónica con dilatación vascular, zonas
de necrosis, fenómenos de reabsorción internos y nula formación del puente
dentinario. Este proceso es asintomático y con ausencia de patología periapical.
Mientras que en los casos donde se aplicó
previamente una
base protectora se observó reorganización celular y formación de dentina
reparadora (Mjör, I. 2002).
A diferencia de
estudios que se efectúan exclusivamente en premolares que van a ser removidos
por indicaciones ortodoncicas, este estudio se llevó a cabo en pacientes de edad
madura.
Este aspecto especialmente es importante ya que las muestras han sido expuestas
al paso del tiempo con la consecuencia natural de diferentes tipos de deterioro
como son la recesión gingival, irritación dentinaria gingival crónica, oclusión
y desgaste oclusal, algunos tipos de restauraciones, etc. Los estudios
efectuados en dientes jóvenes nos muestran un panorama general de la respuesta
pulpar,
pero este estudio en piezas maduras muestran los resultados del
trabajo que los clínicos efectuamos diariamente en pacientes de edad y situación
real.
Se ha demostrado
que existe gran diferencia entre el concepto de vitalidad y sensibilidad
(Stanley, H. Pameijer C. 1997), de tal forma que el tejido pulpar puede estar en
un proceso de necrosis y responder positivo a los estímulos como los cambios de
temperatura como respuesta de vitalidad, pero es bien conocido que el tejido
nervioso en un proceso necrótico es el último que muere, así que en estos casos
se puede detectar sensibilidad pulpar sin vitalidad pulpar confundiendo el
diagnostico clínico. Llama la atención en los resultados de este estudio que
ninguno de los pacientes presentó dolor o molestias, en el diagnóstico clínico
bimestral ninguna de las muestras presentó aumento de sensibilidad o pérdida de
ésta. En el diagnostico radiográfico bimestral no se presentó cambio perceptible
en las placas radiográficas comparadas con las del diagnostico inicial ni entre
las tomas subsecuentes. Es importante destacar que estas mismas piezas en los
cortes histológicos mostraron un proceso degenerativo pulpar y necrosis causados
por los adhesivos en la pulpa. Así, podemos concluir que la ausencia de
sintomatología no necesariamente representa el estado de salud pulpar.
Conclusiones y
Recomendaciones
De acuerdo con los
resultados obtenidos en este estudio de investigación, podemos concluir que en
cavidades profundas donde el espesor remanente dentinario entre la cavidad
y la cámara pulpar es muy delgado (1.0 mm), el adhesivo fluye a través de los
túbulos dentinarios hasta penetrar a la pulpa causando una reacción inflamatoria
crónica con dilatación vascular, zonas de necrosis, y nula formación del puente
dentinario. Este proceso es asintomático con ausencia de síntomas y signos
patológicos radiográficos. Mientras que en los casos donde se aplicó una base
protectora se observó reorganización celular y formación de dentina reparadora.
En zonas de dentina
profunda es recomendable, previo al grabado dentinario, aplicar hidróxido de
calcio cubierto por un delineador de ionómero de vidrio para así evitar la
toxicidad que dichas sustancias puedan crear a la pulpa y de esta manera no
causar patologías pulpares.
Bibliografía
1. Bränström, M. & Nordenvall, KJ. Bacterial penetration, pulpal reaction and
the inner surface of concise enamel bond. Composite fillings in etched and
unetched cavities. J Dent Res, 1978; 57: 3-10.
2. Bränström, M. Sensibility of dentine. Oral surgery, oral medicine and oral
pathology, 1966; 21: 517.
3. Camps, J. Dejou, J. Remusat, M. About, I. Factors influencing pulpal response
to cavity retorations. Dent Mater. 2000 Nov; 16(6): 432-40.
4. Christensen, G. Should we be bonding all tooth restorations. JADA 1994; 11:
193-194.
5. Costa CA. Hebling J. In: Heostroza G, editor. Adhesión en Odontología
Restauradora, Editorial MAIO, 2003. 163-195.
6. Costa, CA. Hebling, J. Respuesta de pulpas humanas recubiertas con materials
resinosos. Estética y Operatoria Dental. ALODYB. Lima, Perú. 2002. Pág: 50-53.
7. Costa, CA. Teixeira, HM. do Nascimento, AB. Hebling, J. Biocompatibility of
an adhesive system and 2-hydroxyethylmethacrylate. ASCD J Dent Child. 1999;
66(5): 337-42, 294.
8. Cox CF. et al. Biocompatibility of primer adhesive and resin composite
systems on non- exposed and exposed pulps of non-human primate teeth. Am J Dent
1998; 10: 55-63.
9. Craig R. Materiales de odontología restauradora. Ed. Harcourt Brance Madrid
España. 1998; 244-272.
10. Fusayama, T. Factors and prevention of pulp irritation by adhesive composite
resin restorations. Quintessence Int, 1987; 18, (9): 633-641.
11. Gerurtsen, W. Biocompatibility of resin-modified filling materials. Crit Rev
Oral Med 2000; 11(3): 333-55.
12. Hebling, J. Giro, EM. Human pulp response after an adhesive system
application in deep cavities. J Dent. 1999; 27: 557-60.
13. Majör, IA. Ferrari, M. Pulp-dentin biology in restorative dentistry. Part.
6: Reactions to restorative materials, tooth-restoration interfaces, and
adhesive techniques. Quintessence Int. 2002; 33: 35-63.
14. Majör, I. Pulp-Dentin Biology in Restorative Dentistry. Quintessence Books.
2002.
15. Stanley, H. Pameijer, C. Dentistry’s Friend: Calcium Hydroxide. Op Dent 1997
Jan.; (1): 1-3.
16. Mondelli, J. Proteçâo do complexo dentinopulpar. Ed. Artes Médicas. São
Paolo, Brasil. 1998; 97-131.
17. Shuster, GS. Caughman, GB. Rueggeberg, FA. Changes in cell phospholipids
metabolism in vitro in the presence of HEMA and its degradation products. Dent
Mater. 2000. Jul; 16(4): 297-302.
18. Stanley, HR. Going, RE. Chauncey, HH. Human pulp response to acid
pretreatment of dentin and composite restorations. J Amer Dent Ass, 1975; 91
(10): 817-825.
19. Pashley, DH. et al. Effects of dentin permeability in vivo in the dog. Arch
oral Bigl 1984; 29:725.
20. Pashley, DH. et al. Permeability of demineralized dentin to HEMA. Dent
Mater. 2000; 16(1): 7-14.
21. Rakich, DR. Wataha, JC. Lefebvre, CA. Weller, RN. Effect of dentin bonding
agents on the secretion of inflammatory mediators from macrophages. J Endod.
1999, Feb; 25(2): 114-7.
|

